Met behulp van embryo-modellen hopen wetenschappers ivf-behandelingen te verbeteren.
Slechts dertig procent van de embryo’s die ontstaan bij ivf, nestelt in na terugplaatsing in de baarmoeder. Vervolgens gaat het bij een kwart van de ingenestelde embryo’s alsnog mis: de vrouwen krijgen aanvankelijk een positieve zwangerschapstest, maar verliezen het vruchtje twee weken later. Onderzoekers vermoeden dat dit komt door afwijkingen in de aantallen chromosomen; de dragers van het erfelijke materiaal.
Om te onderzoeken waarom ivf-trajecten zo vaak misgaan, gebruiken wetenschappers sinds 2021 een bepaald soort embryo-modellen: blastoïden. Blastoïden bootsen de fase van de embryonale ontwikkeling na waarin het embryo zich innestelt in de baarmoeder. Embryo’s in die zogeheten blastulafase heten blastocysten en ‘oïde’ betekent ‘achtig’. Vandaar blastoïden, omdat het om modellen gaat.
Een blastocyst ziet eruit als een klein blaasje, waarvan de buitenste laag cellen een holte omsluit waarin zich een klompje cellen bevindt. De buitenste cellaag zorgt voor de innesteling in de baarmoeder en vormt de placenta, terwijl het binnenste klompje cellen uitgroeit tot het embryo. Blastoïden moeten zo goed mogelijk op zo’n blastocyst lijken.
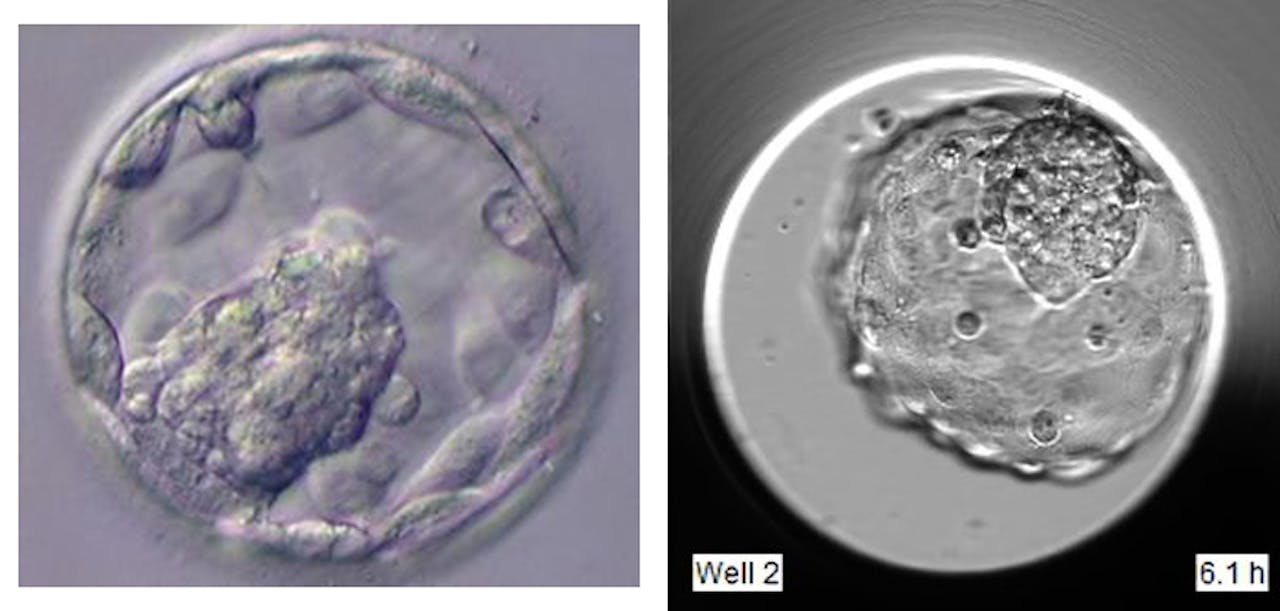
Humane blastocyst versus blastoïde
Erasmus MC IVF kliniekDie modellen zijn hard nodig. Zonder modellen zijn onderzoekers aangewezen op proefdieren zoals muizen als ze de vroege embryonale ontwikkeling willen bestuderen. Maar de ontwikkeling van muis en mens komt niet helemaal overeen. Muizenembryo’s ontwikkelen zich bijvoorbeeld veel sneller. De innesteling gebeurt bij mensen tussen dag 5 en 7. Bij muizen is dit al op dag 4. De totale zwangerschap bij een muis duurt drie weken, bij de mens zijn dat er veertig.
Een andere optie voor onderzoekers zijn zogeheten restembryo’s die over zijn na een ivf-behandeling. Mensen die een ivf-traject doorlopen kunnen deze embryo’s aan de wetenschap doneren. Hoewel onderzoek met deze restembryo’s heel nuttig is, kleven er ook nadelen aan. Zo zijn er relatief weinig beschikbaar en zijn ze niet altijd van topkwaliteit.
Uitgekiende cocktail
Als onderzoekers cellen uit de blastocyst halen en in het lab verder laten groeien, ontstaan embryonale stamcellen. Die cellen behouden het vermogen om alle embryonale weefsels te vormen. Onderzoekers hoeven dit niet iedere keer opnieuw te doen. Omdat de cellen continu blijven delen, ontstaan steeds nieuwe cellen die de wetenschappers kunnen gebruiken. Een cellijn heet dat.
Om een humane blastoïde te maken, voegen wetenschappers die embryonale stamcellen in een buisje samen met een uitgekiende cocktail van eiwitten die de cellen stimuleren te delen en te veranderen. Zo ontstaat spontaan een bolletje dat veel lijkt op de beginfase van een embryo op dag 5 na de bevruchting. De periode waarin een embryo normaal gesproken gaat innestelen dus.
Het grote voordeel is dat onderzoekers makkelijk grote aantallen van deze modellen kunnen maken in het laboratorium. Ook kunnen ze makkelijk veranderingen in bijvoorbeeld het DNA aanbrengen om de gevolgen daarvan te onderzoeken.
En dat is belangrijk, want met blastoïden hopen wetenschappers als Jop Kind van het Hubrecht Instituut en Derk ten Berge van het Erasmus MC onder andere te ontdekken welke genen bij een embryo cruciaal zijn voor een goede innesteling. Als er door afwijkingen in die genen bijvoorbeeld fouten optreden tijdens de celdeling, kunnen cellen een ongelijk aantal chromosomen krijgen. “Vijftien jaar geleden ontdekten onderzoekers dat dit ongelijke chromosomenaantal vaak voorkomt in menselijke ivf-embryo’s. Mogelijk is dit een hoofdoorzaak van zwangerschapsverlies”, zegt Ten Berge.
Oerknal van het leven
Om dit te onderzoeken, gebruiken Ten Berge en Kind menselijke modellen. In tegenstelling tot wetenschappers die met muismodellen werken, plaatsen zij menselijke embryo-modellen niet terug in een baarmoeder, maar op een voedingsbodem, dat de baarmoederwand moet nabootsen in het lab.
Het lastige is alleen dat eigenlijk niemand weet hoe vergelijkbaar dit soort embryo-modellen zijn met echte embryo’s, en hoe nuttig ze dus zijn. Ten Berge: “We zijn daarom bezig om restembryo’s door te kweken naar een stadium tot na de implantatie. Ook hierbij weten we niet of zij doorgroeien op dezelfde manier als in een baarmoeder, maar het is het beste vergelijkingsmateriaal dat we hebben.”
“We gaan de embryo’s die we uit ivf-onderzoek krijgen op allerlei manieren onderzoeken om zoveel mogelijk van de ontwikkeling in kaart te brengen”, zegt Kind. Dat doen de onderzoekers al vanaf de allereerste delingen die de bevruchte eicellen doormaken; de zogeheten klievingsdelingen. Sommige embryo’s hebben namelijk al direct na de bevruchting problemen. Zulke embryo’s redden het niet als je ze terug zou plaatsen in de baarmoeder en worden normaal gesproken weggegooid. “Vaak kunnen ze nog wel de ontwikkeling tot aan de innesteling doormaken en dat maakt ze geschikt voor ons onderzoek”, legt Ten Berge uit. Kind: “We kijken naar signalen die de cellen elkaar geven, welke eiwitten aangemaakt worden en welke delen van het DNA wanneer geactiveerd zijn.”
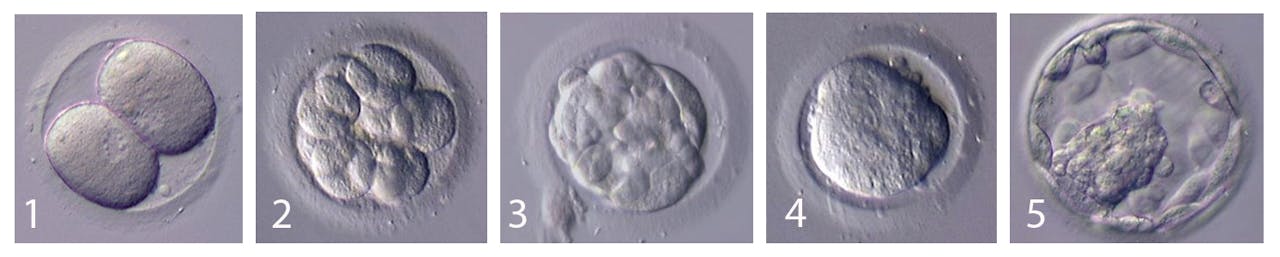
Een humaan embryo vanaf 2-celstadium tot het blastocyststadium
Erasmus MC IVF kliniek“Tijdens die eerste delingen begint ook de transcriptie [het proces waarbij DNA wordt afgelezen om uiteindelijk eiwitten te maken, red.]. Het moment dat transcriptie aangaat kun je wel zien als oerknal van het leven. Het is fantastisch om dat moment te zien.” Ten Berge: “Dat helpt ons allemaal om die embryonale ontwikkeling te begrijpen.”
Allemaal fantasie
Datzelfde onderzoek doen ze vervolgens ook met de blastoïden, modellen dus. Het kan zijn dat die twee op bepaalde punten verschillen. Maar dat hoeft volgens de onderzoekers niet erg te zijn. Ten Berge: “Het zijn juist de gebreken in een model die ons laten zien welke factoren cruciaal zijn in de ontwikkeling.” Want wat gebeurt er bijvoorbeeld in het model als bepaalde eiwitten of signalen ontbreken? En op wat voor een manier verschilt dat met wat er gebeurt in het echte embryo?
Eind november bleek uit Maastrichts onderzoek dat bij vroege miskramen veel vaker dan tot nu toe gedacht sprake is van genetische afwijkingen in het embryo. Die afwijkingen komen voor bij bijna 70 procent van de miskramen in de eerste drie maanden van de zwangerschap.
Ook in ivf-embryo’s komen vaak ongelijke aantallen chromosomen voor. Kind en Ten Berge willen weten hoe dat kan. Én ze hopen te ontdekken hoe chromosomale afwijkingen de ontwikkelingsmechanismen van embryo’s beïnvloeden.
Als dat bekend is, is een laatste stap om behandelingen te onderzoeken die een gezonde ontwikkeling bevorderen. Ten Berge: “Als we een manier bedenken om afwijkende cellen op te sporen en te verwijderen, dan kan een embryo misschien alsnog normaal ontwikkelen. Of misschien vinden we wel een manier waarop abnormale cellen stoppen met groeien, waardoor het embryo het niet redt en je dus geen embryo’s terugplaatst die toch geen kans hebben.” Hij benadrukt dat dit allemaal nog heel hypothetisch is. “We weten nog helemaal niet hoe dit gaat lopen.”
De onderzoekers zijn tevreden als ze de komende jaren meer leren over de menselijke embryonale ontwikkeling. Zonder die kennis zullen er ook geen behandelingen komen. Ten Berge: “We weten eigenlijk helemaal niks over humane embryo’s. We weten heel veel over embryo’s van fruitvliegen, kippen, kikkers en rondwormen. Maar mensen zijn een groot mysterie. Al die prachtige tekeningen die we tijdens biologiecolleges laten zien? Allemaal fantasie. Met zowel restembryo’s als modellen hopen we de werkelijkheid in beeld te brengen.”